개 비장 혈관육종(HSA)에서 임상적 의미가 있는 게놈 변화의 확인
Timothy Estabrooks , Anastasia Gurinovich , Jodie Pietruska , Benjamin Lewis , Garrett Harvey , Gerald Post , Lindsay Lambert , Aubrey Miller , Lucas Rodrigues , Michelle E. White , Christina Lopes , Cheryl A. London , Kate Megquier는 9월 21일에 다음 기사를 게재했습니다. 2023년 연구:
https://onlinelibrary.wiley.com/doi/10.1111/vco.12925
이 연구는 개의 내피 세포에 영향을 미치고 공격성과 짧은 생존 기간을 특징으로 하는 심각한 형태의 암인 개 비장 혈관육종(HSA)의 게놈 변화를 조사합니다. 이 연구의 목표는 개를 위한 치료 전략을 개발하고 유사하고 희귀한 공격성 암인 인간 혈관육종에 대한 통찰력을 얻기 위해 HSA의 게놈 환경에 대한 근본적인 이해를 개발하는 것입니다.
이 연구는 원발성 비장 HSA 진단을 받고 모두 비장절제술을 받고 FidoCure® 정밀 의학 플랫폼을 통해 종양의 서열을 분석한 109마리의 개 샘플을 기반으로 합니다. 체중, 연령, 품종, 진단 당시의 전이, 전반적인 생존율을 후향적으로 평가하였다.
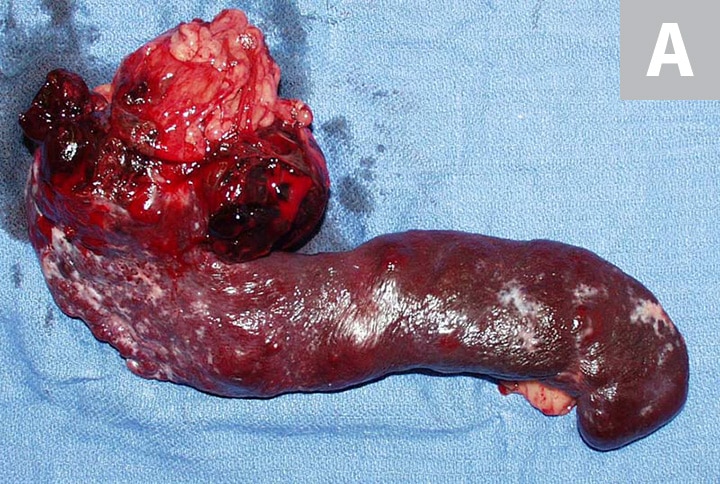
(C) https://www.cliniciansbrief.com/article/canine-hemangiosarcoma
중요한 발견들:
일반적인 돌연변이:
이번 연구에서는 TP53, NRAS, PIK3CA 유전자에서 일반적인 체세포 돌연변이가 확인되었습니다.
생존과의 관계:
이번 연구에서는 HSA의 생존이 진단 시 전이의 존재와 SETD2 및 NOTCH1 유전자의 생식계열 변이와 연관되어 있음을 발견했습니다.
연령 및 인종과의 관계:
진단 당시 연령은 체세포 NRAS 돌연변이 및 인종과 상관관계가 있었습니다. 큰 개는 체세포 TP53 및 PIK3CA 돌연변이에 더 취약한 반면, 작은 개는 SETD2의 생식 계열 변종을 가질 가능성이 더 높았습니다.
예후 요인:
발견된 체세포 돌연변이와 생식계열 변종은 연령, 인종, 전체 생존율 등 임상 변수와 연관되어 있으며, 이러한 유전적 변화는 유리한 예후 인자로 작용할 수 있습니다.
목표:
치료 전략 개발:
주요 목표는 HSA의 게놈 환경을 이해하여 이 암으로 고통받는 개를 위한 치료 전략 개발을 돕는 것입니다.
수의 종양학에서 정밀 의학 개선: 이 연구는 게놈 및 임상 데이터를 활용하여 수의 종양학에서 정밀 의학의 기초를 제공하는 프레임워크를 만드는 것을 목표로 합니다.
시사점:
이 연구는 개의 비장에서 HSA의 게놈 변화와 임상 특징과의 연관성에 대한 귀중한 통찰력을 제공합니다. 이러한 발견은 HSA를 앓고 있는 개를 위한 표적 치료 전략 개발에 도움이 될 수 있으며 다음과 같은 유사한 인간 암의 게놈 환경에 대한 정보를 제공할 수 있습니다. B. 혈관육종. 이 연구는 게놈 변화와 임상 변수 사이의 관계를 이해함으로써 수의 종양학에서 향후 치료법을 잠재적으로 안내할 수 있는 예후 인자를 탐색하는 데 기여합니다.
논의
이 연구는 현재까지 원발성 개 비장 종양(HSA)에 대한 최대 규모의 표적 염기서열 분석 연구이며 생식계열 변종, 체세포 돌연변이 및 연령, 크기 및 결과와 같은 환자 특성 사이의 잠재적 연관성을 식별합니다. 이러한 데이터는 환자 결과를 개선하기 위해 HSA의 특정 치료 취약성을 표적으로 삼는 새로운 치료 전략을 평가하기 위해 향후 연구가 수행될 수 있음을 시사합니다.
생존하다
이용 가능한 데이터로 생존에 대한 차등 효과에 대해 다양한 치료법을 조사할 수는 없었지만, 166일의 중앙 생존 시간(MST)은 치료에 관계없이 비장 HSA에서 역사적으로 보고된 MST와 일치합니다.
체세포 돌연변이
TP53, NRAS, PIK3CA 및 PTEN을 포함하여 이 코호트의 일반적인 체세포 돌연변이는 이전 보고서와 유사한 빈도로 존재했습니다. 우리는 특정 체세포 돌연변이와 생식선 변종의 공존 또는 상호 배타적 패턴을 관찰했는데, 이는 하류 효과의 중복 가능성을 시사합니다. PIK3CA와 PTEN의 돌연변이는 비슷한 결과를 가져올 수 있는 반면, NRAS 돌연변이는 RAS/RAF/MEK/ERK 경로를 활성화합니다. 또한, TP53의 녹다운이 RAS와 독립적으로 RAF/MEK/ERK를 활성화할 수 있다는 증거가 있습니다.
전반적으로, 체세포 돌연변이와 생식계열 변이체의 공존/상호 패턴은 질병 발병을 유발하는 주요 경로 이상이 특정 유전자 조합의 생식계열 또는 체세포 유전적 변형을 통해 달성될 수 있음을 시사합니다. 따라서 체세포 및 생식선 변형에 대한 보다 포괄적인 관점은 전반적인 예후를 결정하고 환자별 치료 전략을 개발하는 데 유익할 수 있습니다.
돌연변이 부하
총 돌연변이 부담이 TP53의 체세포 돌연변이와 상관관계가 있다는 우리의 발견은 이전에 발표된 연구를 복제합니다. PIK3CA와 PTEN은 아직 더 높은 돌연변이 부담과 관련이 없습니다.
생식 계열 배경
특정 개 품종 내에서 암 발병률이 높기 때문에 많은 품종이 암에 걸리기 쉬운 해로운 생식계열 변종을 확립했거나 공통적으로 갖고 있는 것으로 여겨집니다. 이 연구에서 발견된 일반적인 생식계열 변화 중 다수는 MAPK 경로의 상류인 RTK-RAS 경로와 관련이 있습니다. 우리의 결과는 다양한 품종뿐만 아니라 결과에서도 HSA의 발달에 있어 생식계열 배경의 가능한 역할을 강조합니다. SETD2 및 NOTCH1의 변형은 OST 감소와 관련이 있습니다. SETD2는 알려진 종양 억제 유전자이며, SETD2의 희귀 생식계열 변이체는 인간 암 샘플의 DNA 불일치 복구 결함과 관련이 있습니다.
품종별 발견
이 연구에서는 생식 세포 CDKN2A 변종이 독일 셰퍼드에서 훨씬 더 흔하다는 사실을 발견했으며, 이는 이러한 변종이 이 품종의 위험에 기여할 수 있음을 시사합니다. CDKN2A 유전자는 알려진 종양 억제 유전자이며 이 품종에서 빈번한 복제수 삭제 및 손실이 기록되었습니다.
확인된 변종은 722마리의 개와 다른 개과의 생식 세포 자원에서 개 중 약 10%에서 발생합니다. 이 변종은 개 골육종과 관련된 이전에 기술된 생식 세포 변종과 관련하여 다양한 품종의 관련 영역의 하류 및 상류에서 서로 다른 거리에 있습니다.
저먼 셰퍼드, 골든 리트리버, 래브라도 리트리버 간에는 나이의 유의미한 차이와 전체 생존율(OST)의 유의하지 않은 차이도 관찰되었습니다. 이 세 가지 품종의 평균 기대 수명이 다르기 때문에 독일 셰퍼드가 더 빨리 노화되는지 또는 HSA에 대한 강한 성향과 짧은 OST 경향이 품종의 전체 평균 생존을 감소시키는지 여부를 판단하기가 어렵습니다. 골든 리트리버와 래브라도 리트리버도 HSA의 위험이 높으므로 유전적 배경과 노화의 차이가 중요한 역할을 할 수 있습니다.
이 연구는 다양한 개 품종의 건강 위험 및 기대 수명과 관련하여 유전적 변이 및 배경의 가능한 역할을 강조하여 육종 및 수의학에 중요한 정보를 제공합니다.
요약:
이 회고적 연구에서는 개의 원발성 비장 혈관육종(HSA)의 유전적 배경을 다루고 몇 가지 제한 사항을 강조했습니다. 한계에는 이용 가능한 데이터를 기반으로 다양한 치료법이 생존에 다른 영향을 미치는지 여부를 판단할 수 없다는 것이 포함되었습니다.
환자 종양의 샘플링과 서열 분석은 정상 조직과 비교하지 않고 수행되었으며, 이는 생식세포 돌연변이와 체세포 돌연변이 사이의 명확한 구별이 불가능함을 의미합니다. 또한 이 연구는 56개 유전자 패널로 제한되었기 때문에 잠재적인 동인, 복제 수 변경 또는 기타 구조적 변이를 평가할 수 없었습니다. 비코딩 변형도 고려되지 않았습니다.
분석에 사용된 품종 주석은 애완동물 소유자 또는 수의사가 제공한 정보를 기반으로 했으며 유전 데이터로 확인되지 않았습니다. 그럼에도 불구하고, 발표된 데이터에 따르면 대부분의 경우 인종 정보는 유전자 분석과 일치합니다.
결론적으로, 이 연구는 일차 개 비장 HSA의 게놈 환경을 이해하는 데 기여하고 유전적 배경, 체세포 돌연변이 및 임상 변수 사이의 가능한 연관성을 식별합니다. 이들 화합물에 대한 추가 연구가 필요합니다. 개에 대한 적절한 표적 치료 접근법에 대한 게놈 환경의 일치를 개선하기 위한 전향적 연구는 HSA가 있는 개와 AS가 있는 인간 모두의 결과를 개선하는 데 도움이 될 수 있습니다.
또 다른 최신 기사: https://tierarzt-karlsruhe-durlach.de/srma-beim-hund/
약어
AS 혈관육종
CI 신뢰구간
CT 컴퓨터 단층촬영
HSA 혈관육종
MST 중앙 생존 시간
NGS 차세대 시퀀싱
OST 전체 생존 시간
WES 전체 엑솜 시퀀싱
