Ідентифікація геномних змін із клінічними наслідками при гемангіосаркомах селезінки собак (HSA)
Тімоті Естабрукс , Анастасія Гуріновіч , Джоді П'єтруска , Бенджамін , Гаррет Харві , Джеральд Пост , Ліндсі Ламберт , Обрі , Родрігес , Е. , Крістіна Лопес , Шеріл А. Лондон , Кейт Мегк'є опублікували таку статтю 21 вересня, 2023 р. вашого дослідження:
https://onlinelibrary.wiley.com/doi/10.1111/vco.12925
У цьому дослідженні вивчаються геномні зміни гемангіосаркоми селезінки собак (HSA), важкої форми раку, яка вражає ендотеліальні клітини собак і характеризується своєю агресивністю та коротким виживанням. Дослідження спрямоване на розвиток фундаментального розуміння геномного ландшафту HSA, щоб розробити терапевтичні стратегії для собак і отримати уявлення про людську ангіосаркому, порівнянний і рідкісний агресивний рак.
Дослідження базується на вибірці зі 109 собак з діагнозом первинного ураження селезінки, у всіх яких була проведена спленектомія, і чиї пухлини секвенували за допомогою FidoCure® Precision Medicine Platform. Вага, вік, порода, метастази на момент встановлення діагнозу та загальна виживаність собак були ретроспективно оцінені.
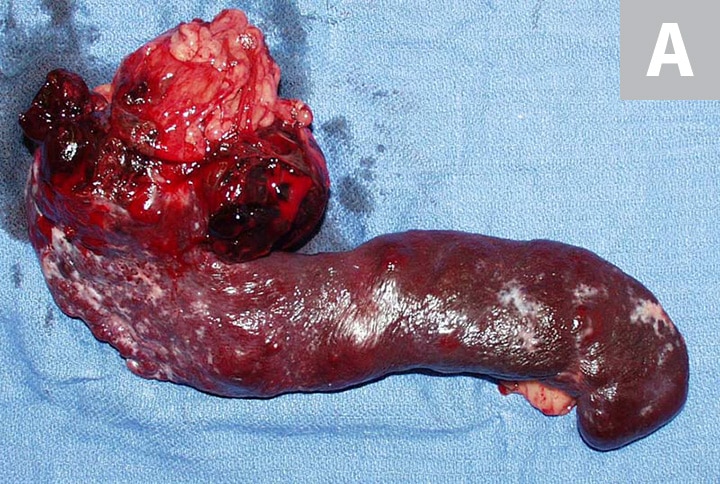
(C) https://www.cliniciansbrief.com/article/canine-hemangiosarcoma
Ключові висновки:
Поширені мутації:
Дослідження виявило поширені соматичні мутації в генах TP53, NRAS і PIK3CA.
Відношення до виживання:
Дослідження показало, що виживаність при HSA пов’язана з наявністю метастазів на момент діагностики та з варіантами зародкової лінії в генах SETD2 і NOTCH1.
Зв'язок з віком і расою:
Вік на момент встановлення діагнозу корелював із соматичними мутаціями NRAS та расою. Великі собаки були більш сприйнятливі до соматичних мутацій TP53 і PIK3CA, тоді як менші собаки частіше мали варіанти зародкової лінії SETD2.
Прогностичні фактори:
Виявлені соматичні мутації та варіанти зародкової лінії були пов’язані з такими клінічними змінними, як вік, раса та загальна виживаність, і ці генетичні зміни можуть служити сприятливими прогностичними факторами.
Цілі:
Розробка терапевтичних стратегій:
Основна мета полягає в тому, щоб зрозуміти геномний ландшафт HSA, щоб допомогти в розробці терапевтичних стратегій для собак, які страждають від цього раку.
Удосконалення прецизійної медицини у ветеринарній онкології: дослідження спрямоване на створення основи, яка використовує геномні та клінічні дані для створення основи для прецизійної медицини у ветеринарній онкології.
Наслідки:
Дослідження дає цінну інформацію про геномні зміни та їх зв’язок із клінічними особливостями HSA в селезінці собак. Ці висновки можуть допомогти в розробці цілеспрямованих терапевтичних стратегій для собак із HSA та можуть пролити світло на геномний ландшафт подібних ракових захворювань людини, таких як: B. ангіосаркоми. Розуміючи взаємозв’язок між геномними змінами та клінічними змінними, це дослідження сприяє вивченню прогностичних факторів, які потенційно можуть керувати майбутнім лікуванням у ветеринарній онкології.
обговорення
Це дослідження є найбільшим цілеспрямованим секвенуванням первинних пухлин селезінки собак (HSA) на сьогоднішній день і визначає потенційні зв’язки між варіантами зародкової лінії, соматичними мутаціями та характеристиками пацієнта, такими як вік, розмір і результат. Ці дані свідчать про те, що майбутні дослідження можуть бути проведені для оцінки нових стратегій лікування, спрямованих на конкретні терапевтичні вразливості HSA для покращення результатів лікування пацієнтів.
Вижити
Незважаючи на те, що за наявними даними не вдалося перевірити різний вплив різних методів лікування на виживаність, середній час виживання (MST) у 166 днів узгоджується з MSTs, історично зареєстрованими при HSA селезінки, незалежно від лікування.
Соматичні мутації
Поширені соматичні мутації в цій когорті, включаючи TP53, NRAS, PIK3CA та PTEN, були присутні з такою ж частотою, як і в попередніх звітах. Ми спостерігали співіснуючі або взаємовиключні закономірності певних соматичних мутацій і варіантів зародкової лінії, що свідчить про можливе накладення наступних ефектів. Мутації в PIK3CA і PTEN можуть мати подібні наслідки, тоді як мутації NRAS активують шлях RAS/RAF/MEK/ERK. Крім того, дані свідчать про те, що нокдаун TP53 може активувати RAF/MEK/ERK незалежно від RAS.
Загалом, моделі співіснування/взаємності як соматичних мутацій, так і варіантів зародкової лінії свідчать про те, що ключові аномалії шляху, що обумовлюють патогенез захворювання, можуть бути досягнуті за допомогою зародкової лінії або соматичної генетичної модифікації конкретних комбінацій генів. Таким чином, більш глобальний погляд на соматичні та зародкові зміни може бути інформативним для визначення загального прогнозу та розробки стратегій лікування для кожного пацієнта.
Мутаційне навантаження
Наш висновок про те, що загальне мутаційне навантаження корелює з соматичними мутаціями в TP53, повторює попередню опубліковану роботу. PIK3CA і PTEN ще не були пов’язані з вищим мутаційним тягарем.
Зародкова лінія фону
Через високу поширеність раку серед певних порід собак вважається, що багато порід мають встановлені або загальні шкідливі варіанти зародкової лінії, які сприяють раку. Багато загальних змін зародкової лінії, виявлені в цьому дослідженні, стосуються шляху RTK-RAS, який знаходиться вище за шлях MAPK. Наші результати підкреслюють можливу роль фону зародкової лінії у розвитку HSA у різних порід, а також у результатах. Варіанти в SETD2 і NOTCH1 були пов’язані зі зниженим ОЗТ. SETD2 є відомим геном-супресором пухлин, і рідкісні варіанти зародкової лінії SETD2 були пов’язані з дефіцитом відновлення невідповідності ДНК у зразках раку людини.
Специфічні для породи знахідки
Це дослідження показало, що варіанти CDKN2A зародкових клітин значно частіше зустрічаються у німецьких вівчарок, що свідчить про те, що ці варіанти можуть сприяти ризику цієї породи. Ген CDKN2A є відомим геном-супресором пухлин, і в цій породі задокументовано часті видалення та втрати кількості копій.
Виявлений варіант зустрічається приблизно у 10% собак у ресурсі зародкових клітин із 722 собак та інших собак. Цей варіант знаходиться на різних відстанях нижче та вище за течією пов’язаних областей у різних порід, порівняно з раніше описаними варіантами зародкових клітин, пов’язаними з остеосаркомою собак.
Значні відмінності у віці та незначні відмінності в загальному виживанні (OST) також спостерігалися між німецькими вівчарками, золотистими ретриверами та лабрадорами. Оскільки ці три породи мають різну середню тривалість життя, важко визначити, чи німецькі вівчарки старіють швидше, чи їх сильна схильність до HSA та тенденція до коротшого OST зменшують загальну середню виживаність породи. Золотисті ретривери та лабрадори також мають високий ризик HSA, тому відмінності в генетичному фоні та старінні можуть відігравати певну роль.
Це дослідження підкреслює можливу роль генетичних варіантів і походження у зв’язку з ризиками для здоров’я та очікуваною тривалістю життя різних порід собак і, таким чином, надає важливу інформацію для розведення та ветеринарії.
Резюме:
Ретроспективне дослідження стосується генетичного фону первинної гемангіосаркоми селезінки (HSA) у собак і висвітлює деякі обмеження. Обмеження включали неможливість визначити, чи різне лікування мало різний вплив на виживання на основі наявних даних.
Відбір зразків і секвенування пухлин пацієнта проводилися без порівняння з нормальною тканиною, що означало, що остаточне розрізнення між зародковою лінією та соматичними мутаціями було неможливим. Крім того, дослідження було обмежено панеллю з 56 генів, тому потенційні драйвери, зміни кількості копій чи інші структурні варіанти не могли бути оцінені. Також не враховувалися варіанти без кодування.
Анотації породи, використані в аналізах, ґрунтувалися на інформації, наданій власниками домашніх тварин або ветеринарами, і не підтверджувалися генетичними даними. Тим не менш, опубліковані дані показують, що в більшості випадків інформація про расу узгоджується з генетичним аналізом.
На завершення це дослідження сприяє розумінню геномного ландшафту первинного HSA селезінки собак і визначає можливі зв’язки між генетичним фоном, соматичними мутаціями та клінічними змінними. Необхідні подальші дослідження цих сполук. Проспективна робота з уточнення відповідності геномних ландшафтів відповідним цільовим терапевтичним підходам у собак може допомогти покращити результати як у собак із HSA, так і у людей із АС.
Інша актуальна стаття: https://tierarzt-karlsruhe-durlach.de/srma-beim-hund/
Скорочення
AS ангіосаркома
CI довірчий інтервал
КТ комп’ютерна томографія
HSA гемангіосаркома
MST середній час виживання
NGS секвенування наступного покоління
OST загальний час виживання
WES секвенування всього екзому
