Identifizierung von Genomveränderungen mit klinischen Auswirkungen bei hündischen Hämangiosarkomen der Milz (HSA)
Timothy Estabrooks, Anastasia Gurinovich, Jodie Pietruska, Benjamin Lewis, Garrett Harvey, Gerald Post, Lindsay Lambert, Aubrey Miller, Lucas Rodrigues, Michelle E. White, Christina Lopes, Cheryl A. London, Kate Megquier veröffentlichten am 21.09.2023 folgenden Artikel zu Ihrer Studie:
https://onlinelibrary.wiley.com/doi/10.1111/vco.12925
In dieser Studie werden die genomischen Veränderungen beim Hämangiosarkom der Milz des Hundes (HSA) untersucht, einer schweren Form von Krebs, die Endothelzellen bei Hunden befällt und durch ihre Aggressivität und kurze Überlebenszeit gekennzeichnet ist. Die Forschung zielt darauf ab, ein grundlegendes Verständnis der genomischen Landschaft des HSA zu entwickeln, um therapeutische Strategien für Hunde zu entwickeln und Erkenntnisse über das menschliche Angiosarkom, eine vergleichbare und seltene aggressive Krebsart, zu gewinnen.
Die Studie basiert auf einer Stichprobe von 109 Hunden, bei denen ein primäres Milz-HSA diagnostiziert wurde, die alle durch eine Splenektomie behandelt wurden und deren Tumore über die FidoCure® Precision Medicine Platform sequenziert wurden. Gewicht, Alter, Rasse, Metastasierung bei der Diagnose und Gesamtüberlebenszeit der Hunde wurden retrospektiv ausgewertet.
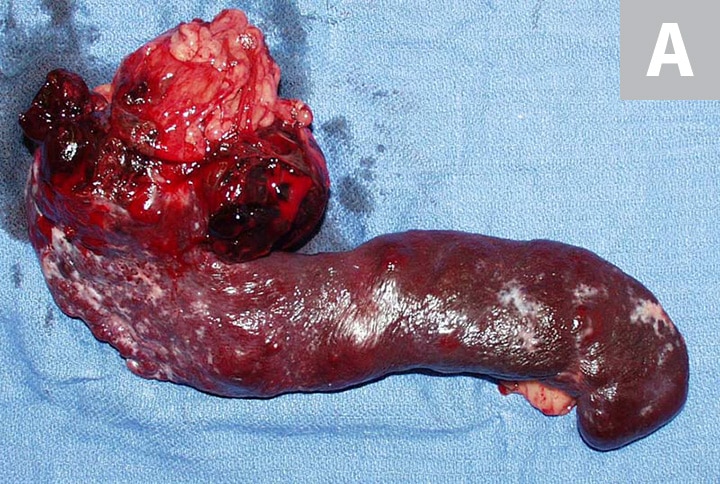
(C) https://www.cliniciansbrief.com/article/canine-hemangiosarcoma
Wichtigste Ergebnisse:
Häufige Mutationen:
Die Forschung identifizierte häufige somatische Mutationen in den Genen TP53, NRAS und PIK3CA.
Zusammenhang mit dem Überleben:
Die Studie ergab, dass das Überleben bei HSA mit dem Vorhandensein von Metastasen bei der Diagnose und mit Keimbahnvarianten in den Genen SETD2 und NOTCH1 zusammenhängt.
Zusammenhang mit Alter und Rasse:
Das Alter bei der Diagnose korrelierte mit somatischen NRAS-Mutationen und der Rasse. Größere Hunde waren anfälliger für somatische TP53- und PIK3CA-Mutationen, während bei kleineren Hunden eher Keimbahnvarianten von SETD2 zu finden waren.
Prognostische Faktoren:
Die entdeckten somatischen Mutationen und Keimbahnvarianten wurden mit klinischen Variablen wie Alter, Rasse und Gesamtüberleben in Verbindung gebracht, und diese genetischen Veränderungen könnten als günstige prognostische Faktoren dienen.
Zielsetzungen:
Entwicklung von Therapiestrategien:
Ein Hauptziel ist es, die genomische Landschaft von HSA zu verstehen, um die Entwicklung von Therapiestrategien für Hunde, die an diesem Krebs leiden, zu unterstützen.
Verbesserung der Präzisionsmedizin in der Veterinär-Onkologie: Die Studie zielt darauf ab, einen Rahmen zu schaffen, der genomische und klinische Daten nutzt, um eine Grundlage für die Präzisionsmedizin in der Veterinäronkologie zu schaffen.
Implikationen:
Die Studie liefert wertvolle Einblicke in die genomischen Veränderungen und deren Zusammenhang mit klinischen Merkmalen bei HSA in der Milz des Hundes. Diese Erkenntnisse könnten bei der Entwicklung zielgerichteter Therapiestrategien für Hunde mit HSA hilfreich sein und könnten Licht in die genomische Landschaft ähnlicher Krebsarten beim Menschen, wie z. B. Angiosarkome, bringen. Durch das Verständnis des Zusammenhangs zwischen genomischen Veränderungen und klinischen Variablen trägt diese Studie zur Erforschung prognostischer Faktoren bei, die möglicherweise als Richtschnur für künftige Behandlungen in der Veterinäronkologie dienen können.
Diskussion
Diese Studie ist die bisher größte gezielte Sequenzierungsstudie von primärem kaninen Milztumoren (HSA) und identifiziert potenzielle Verbindungen zwischen Keimbahnvarianten, somatischen Mutationen und Patientenmerkmalen wie Alter, Größe und Ergebnis. Diese Daten legen nahe, dass zukünftige Studien durchgeführt werden könnten, um neuartige Behandlungsstrategien zu bewerten, die darauf abzielen, spezifische therapeutische Schwachstellen in HSA zu behandeln, um die Patientenergebnisse zu verbessern.
Überleben
Obwohl verschiedene Therapien mit den verfügbaren Daten nicht auf ihre Differentialwirkung auf das Überleben untersucht werden konnten, stimmt die mediane Überlebenszeit (MST) von 166 Tagen mit den MSTs überein, die historisch bei Milz-HSA berichtet wurden, unabhängig von der Behandlung.
Somatische Mutationen
Häufige somatische Mutationen in dieser Kohorte, einschließlich TP53, NRAS, PIK3CA und PTEN, waren in ähnlichen Frequenzen wie in vorherigen Berichten vorhanden. Wir beobachteten koexistente oder sich gegenseitig ausschließende Muster von bestimmten somatischen Mutationen und Keimbahnvarianten, die auf mögliche Überschneidungen in den nachgeschalteten Effekten hinweisen. Die Mutationen in PIK3CA und PTEN könnten ähnliche Konsequenzen haben, während NRAS-Mutationen den RAS/RAF/MEK/ERK-Weg aktivieren. Darüber hinaus deuten Beweise darauf hin, dass der Knockdown von TP53 RAF/MEK/ERK unabhängig von RAS aktivieren kann.
Gesamt gesehen deuten die Muster der Koexistenz/Gegenseitigkeit sowohl von somatischen Mutationen als auch von Keimbahnvarianten darauf hin, dass Schlüsselweg-Anomalien, die die Krankheitspathogenese antreiben, durch Keimbahn- oder somatische genetische Veränderung bestimmter Genkombinationen erreicht werden können. Daher könnte eine globalere Sicht auf somatische und Keimbahnänderungen informativ sein, um die gesamte Prognose zu bestimmen und patientenspezifische Behandlungsstrategien zu entwickeln.
Mutationslast
Unsere Erkenntnis, dass die gesamte Mutationslast mit somatischen Mutationen in TP53 korreliert, repliziert frühere veröffentlichte Arbeiten. PIK3CA und PTEN wurden bisher nicht mit einer höheren Mutationslast in Verbindung gebracht.
Keimbahn-Hintergrund
Aufgrund der hohen Prävalenz von Krebs innerhalb spezifischer Hunderassen wird angenommen, dass viele Rassen festgelegte oder häufige schädliche Keimbahnvarianten haben, die zu Krebs prädisponieren. Viele der in dieser Studie gefundenen gemeinsamen Keimbahnänderungen betreffen den RTK-RAS-Weg, der dem MAPK-Weg vorgelagert ist. Unsere Ergebnisse unterstreichen die mögliche Rolle des Keimbahn-Hintergrunds in der Entwicklung von HSA in verschiedenen Rassen sowie im Ergebnis. Varianten in SETD2 und NOTCH1 waren mit einer verringerten OST verbunden. SETD2 ist ein bekanntes Tumorsuppressorgen, und seltene Keimbahnvarianten in SETD2 wurden mit Defiziten in der DNA-Fehlpaarungsreparatur in menschlichen Krebsproben in Verbindung gebracht.
Rassenspezifische Funde
In dieser Studie wurde festgestellt, dass Keimzell-CDKN2A-Varianten bei Deutschen Schäferhunden signifikant häufiger auftreten, was darauf hindeutet, dass diese Varianten möglicherweise zum Risiko dieser Rasse beitragen. Das CDKN2A-Gen ist ein bekanntes Tumorsuppressor-Gen, und bei dieser Rasse wurden häufig Löschungen und Verluste der Kopienzahl dokumentiert.
Die identifizierte Variante tritt bei etwa 10 % der Hunde in einer Keimzell-Ressource von 722 Hunden und anderen Kaniden auf. Diese Variante liegt in Bezug auf zuvor beschriebene Keimzell-Varianten, die mit kaninem Osteosarkom in Verbindung gebracht werden, in unterschiedlichen Abständen stromabwärts bzw. stromaufwärts von den assoziierten Regionen bei verschiedenen Rassen.
Es wurden auch signifikante Unterschiede im Alter und nicht signifikante Unterschiede in der Gesamtüberlebenszeit (OST) zwischen Deutschen Schäferhunden, Golden Retrievers und Labrador Retrievern beobachtet. Da diese drei Rassen unterschiedliche durchschnittliche Lebenserwartungen haben, ist es schwierig festzustellen, ob Deutsche Schäferhunde schneller altern oder ob ihre starke Prädisposition für HSA und ihre Tendenz zu kürzeren OST das durchschnittliche Überleben der Rasse insgesamt verringern. Golden Retrievers und Labrador Retriever haben ebenfalls ein hohes HSA-Risiko, so dass Unterschiede im genetischen Hintergrund und Alterung eine Rolle spielen können.
Diese Untersuchung betont die mögliche Rolle genetischer Varianten und Hintergründe im Bezug auf die gesundheitlichen Risiken und Lebenserwartungen verschiedener Hunderassen und liefert somit wichtige Informationen für die Zucht und Tiermedizin.
Zusammenfassung:
Die retrospektive Studie befasst sich mit den genetischen Hintergründen des primären splenischen Hämangiosarkoms (HSA) bei Hunden und zeigt einige Limitierungen auf. Zu den Limitierungen gehörte die Unfähigkeit, festzustellen, ob verschiedene Behandlungen einen unterschiedlichen Effekt auf das Überleben hatten, aufgrund der verfügbaren Daten.
Die Probenentnahme und Sequenzierung der Patiententumoren erfolgte ohne Abgleich mit normalem Gewebe, wodurch eine definitive Unterscheidung zwischen Keimbahn- und somatischen Mutationen nicht möglich war. Zudem war die Untersuchung auf ein Panel von 56 Genen begrenzt, weshalb potenzielle Treiber, Kopienzahlveränderungen oder andere strukturelle Varianten nicht bewertet werden konnten. Nichtcodierende Varianten wurden ebenfalls nicht berücksichtigt.
Die in den Analysen verwendeten Rasseannotationen basierten auf den Angaben von Tierbesitzern oder Tierärzten und wurden nicht durch genetische Daten bestätigt. Dennoch weisen veröffentlichte Daten darauf hin, dass die Angaben zur Rasse in den meisten Fällen mit den genetischen Analysen übereinstimmen.
Abschließend leistet diese Studie einen Beitrag zum Verständnis der genomischen Landschaft des primären kaninen splenischen HSA und identifiziert mögliche Verbindungen zwischen genetischem Hintergrund, somatischen Mutationen und klinischen Variablen. Weitere Untersuchungen zu diesen Verbindungen sind notwendig. Prospektive Arbeiten zur Verfeinerung der Übereinstimmung von genomischen Landschaften mit geeigneten zielgerichteten Therapieansätzen bei Hunden könnten dazu beitragen, die Ergebnisse sowohl bei Hunden mit HSA als auch bei Menschen mit AS zu verbessern.
Ein weiterer aktueller Artikel: https://tierarzt-karlsruhe-durlach.de/srma-beim-hund/
Abkürzungen
AS angiosarcoma
CI confidence interval
CT computed tomography
HSA hemangiosarcoma
MST median survival time
NGS next-generation sequencing
OST overall survival time
WES whole exome sequencing
